La EMA pide suspender la comercialización de 400 medicamentos genéricos
Encuentra "insuficientes" los estudios de bioequivalencia realizados por la empresa Synapse Labs
Varios medicamentos genéricos han sido suspendidos del mercado de la UE, al consideran sus estudios poco fiables. El Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) ha recomendado la suspensión de la autorización de comercialización de más de 400 medicamentos genéricos cuyos estudios de bioequivalencia realizó la empresa india Synapse Labs y de los que se concluye que la información aportada es "insuficiente".
Los estudios de bioequivalencia se llevan a cabo para demostrar que un medicamento genérico libera al organismo la misma cantidad de principio activo que el medicamento de referencia. Una inspección de buenas prácticas clínicas puso de manifiesto irregularidades en los datos de los estudios y deficiencias en la documentación de los mismos, así como en los sistemas y procedimientos informáticos para procesar adecuadamente los datos del estudio. Esto suscitó serias dudas sobre la validez y fiabilidad de los datos de los estudios de bioequivalencia realizados.
Solo 35 medicamentos diponían de datos suficientes
El CHMP, del que forma parte la Agencia de Medicamentos y Productos Sanitarios (AEMPS), examinó toda la información disponible, incluidos los datos de bioequivalencia disponibles procedentes de otras fuentes, para llegar a su conclusión sobre los más de 400 medicamentos cuyos estudios de bioequivalencia fueron realizados por Synapse Labs en nombre de compañías farmacéuticas de la Unión Europea (UE).
Solo 35 de los medicamentos evaluados disponen de datos suficientes para demostrar la bioequivalencia, por lo que se mantendrá la autorización de comercialización de estos medicamentos y podrán continuar en el mercado.
Para los demás medicamentos no se dispone de datos o estos eran "insuficientes" para demostrar la bioequivalencia, por lo que el CHMP ha recomendado suspender su autorización de comercialización. Para levantar la suspensión, las compañías deberán aportar datos alternativos que demuestren la bioequivalencia. Los medicamentos cuyas solicitudes de autorización de comercialización en curso se basen únicamente en datos de Synapse Labs no recibirán autorización en la UE.
Algunos de los medicamentos cuya suspensión se ha recomendado pueden ser de importancia crítica (por ejemplo, debido a la falta de alternativas disponibles) en algunos Estados miembro de la UE. Las autoridades nacionales evaluarán la situación y podrán aplazar la suspensión de estos medicamentos un máximo de dos años en interés de los pacientes. Las compañías tienen que presentar los datos de bioequivalencia requeridos para estos medicamentos en el plazo de un año.
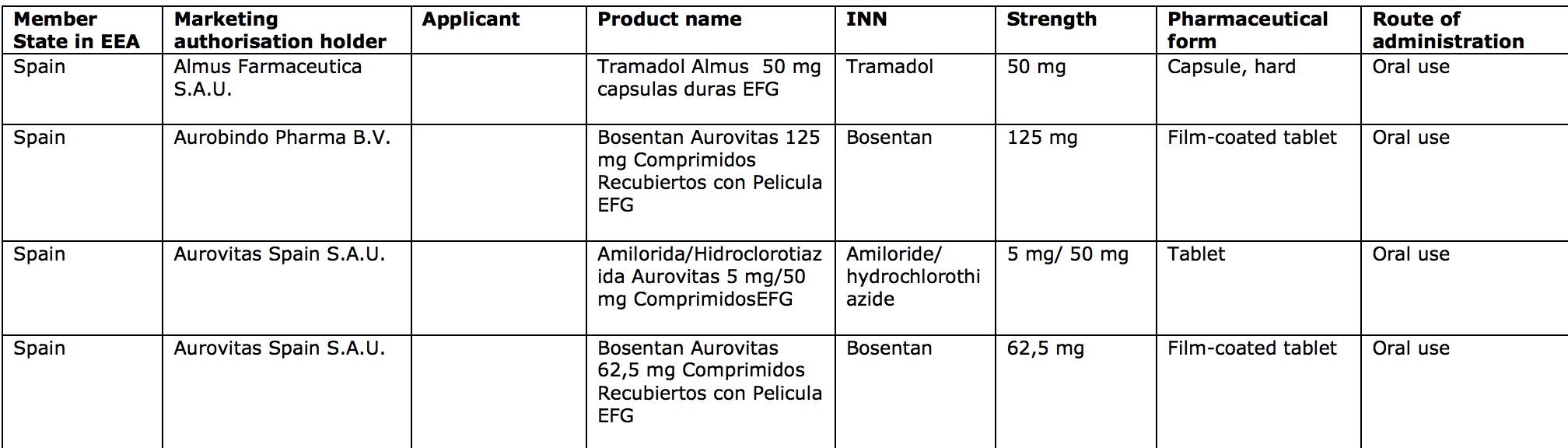
Tramadol o metformina, entre los afectados
Concretamente, la lista publicada por la EMA muestra que en España se ha pedido la suspensión de comercialización de 100 medicamentos genéricos de las farmacéuticas Almus Farmacéutica, Aurobindo Pharma, Aurovitas Spain, Baxter B.V, Eugia Pharma, Glenmark Arzneimittel, GP-Pharm, Stada, Cinfa, Q Pharma, Mabo Farma, Milstein, Mylan Paharmaceuticals, Pharmaselect International Beteiligungs Gmb, Reddy Pharma Iberia, Sandoz, Umedica Netherlands, Vegal Farmaceutica y Viatris Limited.
Entre los medicamentos genéricos afectados en España producidos por estas farmacéuticas se encuentran el analgésico tramadol almus 50 mg, metformina almus 850 mg y 1.000 mg; o sitagliptina Sandoz, entre otros.
El CHMP y las autoridades nacionales seguirán colaborando estrechamente para garantizar que los estudios sobre medicamentos de la UE se lleven a cabo con arreglo a la ley y que las compañías cumplan todos los aspectos de las buenas prácticas clínicas. Si las compañías no cumplen las normas exigidas, las autoridades tomarán las medidas necesarias para garantizar la integridad de los datos utilizados para aprobar medicamentos de la UE.

Información para pacientes y profesionales sanitarios
A raíz de la noticia, desde la Agencia Española del Medicamento lanzan una serie de aclaraciones para pacientes y profesionales sanitarios:
- Hasta el momento no hay eviencia problemas de seguridad o falta de eficacia con ninguno de los medicamentos afectados. Sin embargo, los medicamentos se han suspendido hasta que se disponga de datos que apoyen su bioequivalencia procedentes de fuentes más fiables.
- Los pacientes que tomen alguno de los medicamentos afectados pueden ponerse en contacto con su profesional médico o farmacéutico para obtener información sobre las alternativas existentes.
- Las autoridades nacionales de la UE estudiarán la importancia de cada medicamento en su país y decidirán si lo suspenden o permiten que siga disponible mientras se obtienen nuevos datos.