
EEUU aprueba, entre una fuerte polémica, un fármaco que aseguran es capaz de combatir el alzhéimer
Martes 8 de junio de 2021
ACTUALIZADO : Martes 8 de junio de 2021 a las 19:14 H
9 minutos
Los críticos con el nuevo medicamento dicen que sus supuestos beneficios son menores que sus riesgos
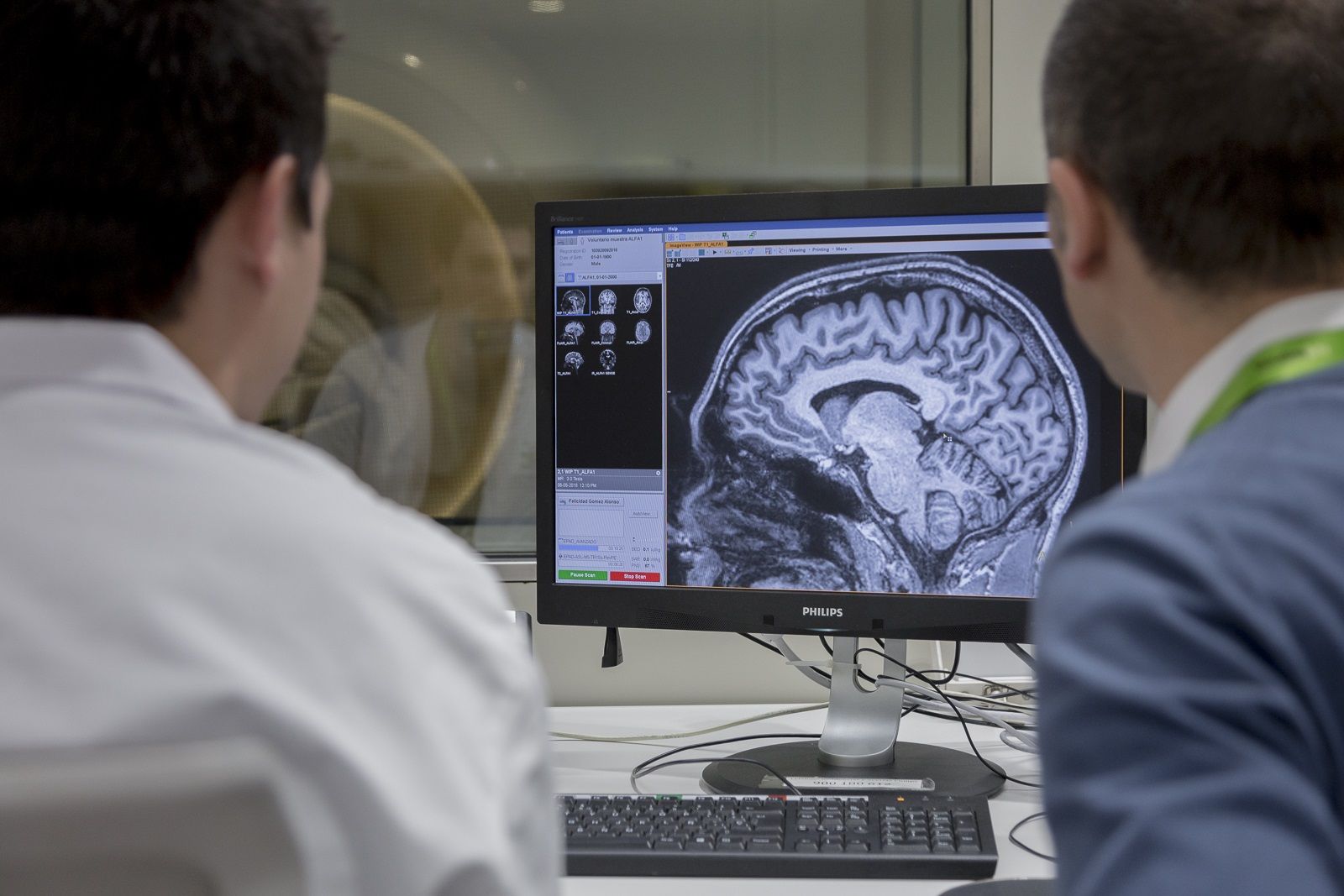
La Agencia del Medicamento de Estados Unidos (FDA por sus siglas en inglés), ha dado su “aprobación acelerada” o de urgencia para la comercialización del "Aducanumab", un medicamento que ha sido desarrollado por el laboratorio Biogen. Se trata del primer fármaco aprovado que está específicamente diseñado para combatir la enfermedad y el deterioro cognitivo que produce el alzhéimer, no como el resto de medicamentos admitidos hasta ahora que, simplemente, ayudaban a aliviar los síntomas de la enfermedad y retrasar unos cuantos meses el declive cerebral.
"Los pacientes que recibieron el tratamiento tuvieron una reducción significativa de la placa beta-amiloide dependiente de la dosis y el tiempo, mientras que los pacientes del grupo de control de los estudios no tuvieron reducción de la placa", ha señalado en un comunicado la FDA.

Esta que sin duda debería ser una noticia que todo el mundo debería estar celebrando, es sin embargo motivo de una agria polémica puesto que la FDA ha aprobado la comercialización del medicamento en contra de la opinión manifestada públicamente de un comité asesor independiente en el que se integran varios expertos, que cuestiona abiertamente la efectividad del "Aducanumab".
La advertencia parece haber causado su efecto puesto que la propia FDA ha condicionado la aprobación definitiva a que Biogen realice un nuevo ensayo clínico con el medicamento.
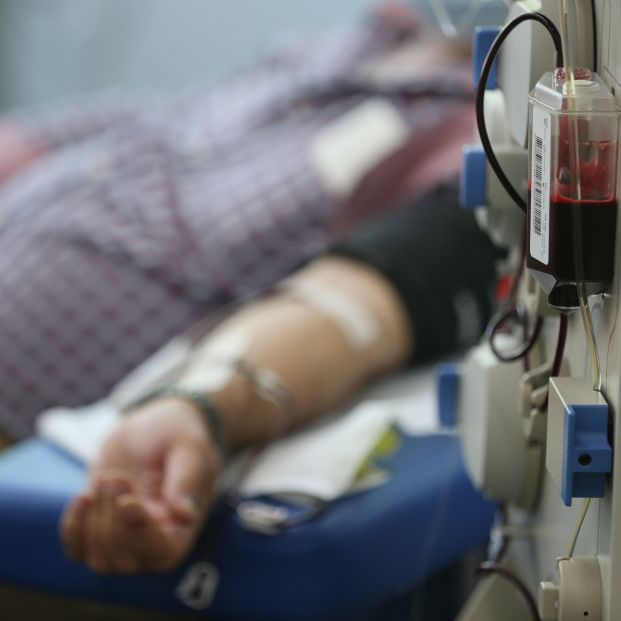
Transfusión intravenosa
Aducanumab, que una vez comercializado cambiará su nombre comercial por el de "Aduhelm" y Biogen también ha solicitado ya autorización para distribuirlo en la Unión Europea, Brasil y Japón.
Se trata de un fármaco pensado para el tratamientos de enfermos con problemas cognitivos suaves o que se encuentren en las primeras etapas de demencia vinculadas al Alzhéimer.
El tratamiento consiste en administrar mensualmente una transfusión intravenosa con un anticuerpo monoclonal que provoca una respuesta inmune y elimina las denominadas placas seniles, depósitos extracelulares de beta amiloide que obstaculizan la conexión de las células cerebrales matan las neuronas.
De esta forma, según el doctor Richard Isaacson que participó en los ensayos, se consigue aliviar los síntomas y ralentizar la progresión de la enfermedad. "Este medicamento se dirige a la fase sintomática más temprana de la enfermedad, llamada deterioro cognitivo leve debido al Alzheimer",añadió.
Por lo que a su precio en el mercado se refiere, el Instituto de Revisión Clínica y Económica anunció en un informe preliminar que se calculaba que el fármaco podría costar entre 2.569 dólares y 8.290 al año.
Estudios contradictorios
En la fase tres del ensayo clínico, la definitiva, se hicieron dos estudios con resultados contradictorios. En el primero de ellos se reducía el deterioro cognitivo en un 22%, pero en el otro no se registró ninguna reacción, por lo que estos estudios se suspendieron en noviembre de 2019 ya que, además, se detectaron una serie de efectos secundarios como dolores de cabeza, mareos o náuseas, y lo más preocupante, inflamaciones y hemorragias cerebrales en el 40% de los pacientes que recibieron las mayores dosis.
Todo ello terminó con la recomendación en contra de la aprobación del comité asesor de la FDA que también advirtió de la excesiva cercanía con Biogen que se daba en el trabajo de esta agencia federal.

Los críticos con el nuevo fármaco argumentan que sus supuestos beneficios, que cuestionan, son menores que los riesgos de hemorragias e inflamaciones cerebrales detectados durante el ensayo clínico.
De hecho, en noviembre de 2020 ninguno de los miembros del Comité Asesor de Medicamentos para el Sistema Nervioso Central y Periférico de la FDA que investiga la efectividad del 'Aducanumab' votó en contra de su eficacia. Diez expertos votaron que no y uno manifestó que tenía serias dudas.
Aprobación acelerada
Son también los críticos quienes recuerdan que una vez aprobado definitivamente el medicamento por la FDA se dificultará enormemente la posibilidad de realizar un nuevo ensayo puesto que en cuanto el medicamento llegue al mercado, ningún posible paciente querrá participar en un ensayo en el que además de existir la posibilidad de recibir un placebo en lugar del verdadero medicamento, puede durar varios años.
“No hay manera de recuperar la oportunidad de entender si el producto funciona de verdad o no” ha advertido el doctor Caleb Alexander, miembro del comité de expertos que asesora a la FDA, que si bien en contadas ocasiones ha revocado la aprobación de medicamentos logradas con el procedimiento de emergencia, también puede mantenerlos en el mercado o exigir un simple cambio de etiquetado si no se confirma la efectividad.
No obstante, el organismo oficial asegura que "si el medicamento no funciona como se esperaba, podemos tomar medidas para retirarlo del mercado".

Aunque la FDA suele escuchar las recomendaciones de sus comités asesores y solicita dos estudios contrastados y convincentes, no es la primera vez que se opta por esta solución, principalmente si se trata de enfermedades graves que aún no tienen tratamiento y aquellos que critican el procedimiento de aprobación acelerada, o de emergencia, explican que con este proceder se rebajan peligrosamente los estándares de aplicación.
Por su parte, el Centro de Investigación de la Enfermedad de Alzheimer Knight de la Universidad de Washington en St. Louis ha emitido un comunicado en el que asegura que "es probable que aún se necesiten varios meses para que el medicamento apruebe otros pasos regulatorios y pueda estar disponible para los pacientes".
Actualmente padecen esta enfermedad degenerativa e incurable 30 millones de personas en el mundo, una cifra que según los cálculos de la OMS, se habrá multiplicado por dos en el años 2050.
Biogen se dispara en Bolsa
Las acciones de Biogen, la biotecnológica se dispararon en Bolsa más de un 38%, después de estar suspendidas por la Bolsa de Nueva York, tras conocerse la decisión de la FDA y, según Bloomberg, han llegado a apreciarse más de un 63%.

Y no es para menos, Biogen fundada en 1978 y con sede en Cambridge, Massachusetts, habría gastado, según Evaluate Pharma, unos 1.630 millones en los ensayos clínicos de este fármaco y los expertos esperan que en ventas máximas al año (o peak sales), la compañía puede llegar a ingresar 8.200 millones de euros.
"Creemos que el medicamento tiene el potencial de generar al menos 10.000 millones de dólares en peak sales y de cambiar completamente el perfil de la compañía", aseguró el prestigioso analista Yatin Suneja en declaraciones recogidas por Reuters.
Varias han sido las grandes compañías que llevan años intentando lanzar al mercado un medicamento contra el alzhéimer y todas ellas habían fracasado hasta ahora. Así le sucedió a Pfizer y Johnson & Johnson que abandonaron sus ensayos en 2013. Sin embargo, en la actualidad Lilly dispone de otro medicamento en fase III de sus ensayos clínicos, la última antes de enfrentarse a una aprobación que en la empresa esperan conseguir próximamente.


